器审中心开启受理前技术问题咨询,为技术开发注入新动能

为进一步优化医疗器械审评审批流程,提升审评效率,国家药品监督管理局医疗器械技术审评中心(以下简称“器审中心”)正式开展了受理前技术问题咨询工作。这一举措旨在加强与申请人的沟通交流,提前识别和解决潜在的技术难题,为医疗器械技术开发提供更加精准、高效的指导与支持,从而加速创新产品的上市进程。
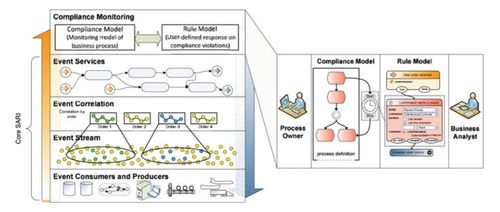
受理前技术问题咨询工作的开展,标志着我国医疗器械审评模式正从传统的“后端审核”向“全程服务”与“早期介入”转变。在医疗器械研发的早期或关键阶段,企业便可就产品设计、性能评价、检验方法、临床评价路径等核心技术问题,向器审中心提出咨询。通过专业、权威的指导,企业能够更好地理解法规要求和技术标准,优化研发方案,规避潜在的技术与合规风险,减少后续正式申报时的反复与补正,有效节省研发成本与时间。
此项工作对于技术开发环节尤为重要。医疗器械,特别是创新型医疗器械的研发,周期长、投入大、技术门槛高。在缺乏明确指引的情况下,企业往往在技术路线选择、验证方法确立等方面存在困惑。器审中心提供的受理前咨询,如同一盏“探照灯”,为企业照亮了技术开发的合规路径。例如,在人工智能医疗软件、新型生物材料、高端有源植入物等前沿领域,审评专家可以就算法验证、生物相容性评价、长期安全性研究等关键点提供前瞻性意见,帮助企业构建科学、完整的证据链,确保研发工作从一开始就建立在坚实可靠的基础上。
为确保咨询工作的质量和效率,器审中心建立了规范的工作流程。申请人需通过指定的平台提交咨询申请,明确咨询的具体技术问题及相关背景资料。中心将组织相关领域的审评专家进行研讨,并在规定时限内给予书面或会议形式的答复。咨询意见虽不作为最终的审评结论,但其基于现行法规和科学认知的指导,具有极高的参考价值。
器审中心受理前技术问题咨询工作的常态化与深化,将有力推动我国医疗器械产业的高质量发展。它不仅降低了企业的研发不确定性,激发了创新活力,更通过审评机构与产业界的深度互动,促进了审评标准与前沿技术的同步发展,共同构建了一个更加开放、协同、高效的医疗器械创新生态系统。这无疑将为保障公众用械安全、推动健康中国建设提供更强有力的技术支撑和制度保障。
如若转载,请注明出处:http://www.grzhf.com/product/6.html
更新时间:2026-02-24 20:09:43